

![]() Hibridación
sp
Hibridación
sp
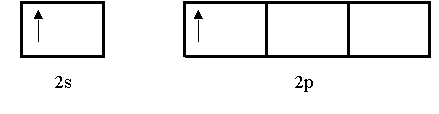
Considérese la molécula de BeCI2 (cloruro de berilio), que se predice lineal de acuerdo con la RPECV. El diagrama orbital para los electrones de valencia del Be es:
 |
Se sabe que en el estado fundamental el Be no forma enlaces covalentes con el Cl porque sus electrones están apartados en el orbital 2s. Así que se recurre a la hibridación para explicar el comportamiento enlazante del Be. Primero un electrón 2s se promueve a un orbital 2p, resultando:
 |
Ahora hay dos tipos diferentes de orbitales del Be disponibles para el enlace, el 2s y el 2p.
La figura muestra la forma y orientación de los orbitales sp.
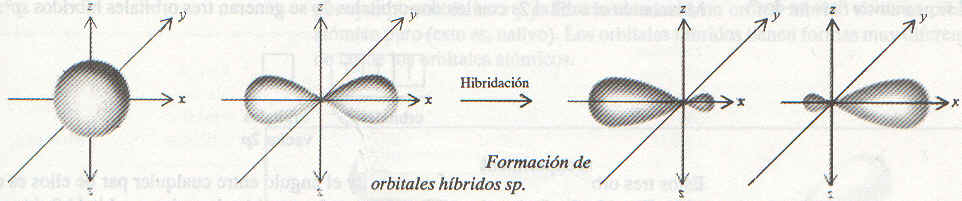 |
Estos dos orbitales hibridos están en la misma línea, el eje x, de modo que el ángulo entre ellos es de 180º. Cada uno de los enlaces BeCl está entonces formado por el traslape del orbital híbrido sp del Be y un orbital 3p del Cl., y la molécula de BeCl2 resultante tiene una geometría lineal.
 |
![]() Hibridación
sp2
Hibridación
sp2
En seguida se hará una revisión somera de la molécula de BF3 (trifluoruro de boro), sabiendo, con base en la RPECV, que tiene geometría plana. Considerando sólo los electrones de valencia, el diagrama orbital del B es:
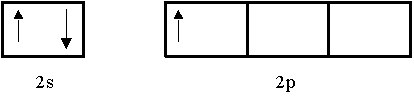 |
Primero, se promueve un electrón 2s a un orbital vacío 2p:
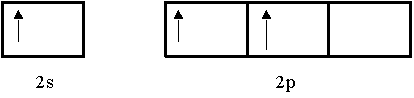 |
Mezclando el orbital 2s con los dos orbitales 2p se generan tres orbitales híbridos Sp2.
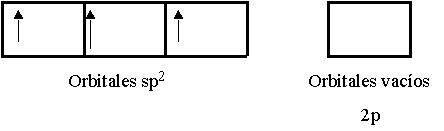 |
Estos tres orbitales sp2 están en un plano, y el ángulo entre cualquier par de ellos es de 120º como se ve en la figura.
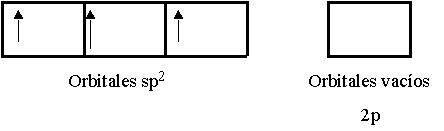 |
Cada enlace BF está formado por el traslape de un orbital híbrido sp2 del boro y un orbital 2p del flúor (como se ve en la figura de abajo). La molécula de BF3 es plana con todos los ángulos FBF de 120º. Este resultado concuerda con los datos experimentales y con las predicciones del modelo de RPECV.
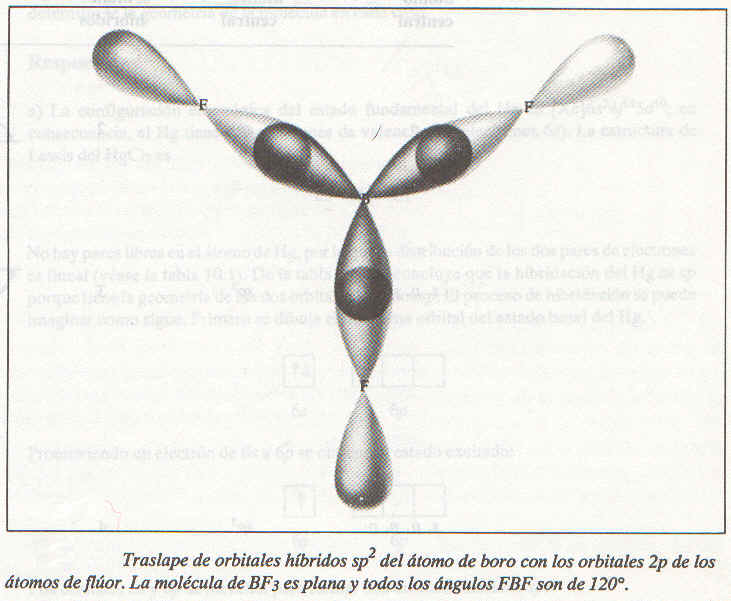 |
Es probable que se haya notado una interesante conexión entre la hibridación y la regla del octeto. Independientemente del tipo de hibridación, un átomo que empieza con un orbital s y tres orbitales p poseerá cuatro orbitales, suficientes para acomodar un total de ocho electrones en un compuesto. Para los elementos del segundo periodo de la tabla periódica, ocho es el número máximo de electrones que pueden acomodar estos elementos. Ésta es la razón por la que la regla del octeto por lo general se cumple en los elementos del segundo periodo.
La situación es diferente para un átomo de un elemento del tercer periodo. Si sólo se usan los orbitales 3s y 3p del átomo para formar orbitales híbridos en una molécula, entonces se cumple la regla del octeto. Sin embargo, en algunas otras moléculas el mismo átomo puede usar uno o más orbitales 3d, además de los 3s y 3p, para formar orbitales híbridos. En estos casos no se cumple la regla del octeto.
Los siguientes puntos son útiles para entender la hibridación:
|
El concepto de hibridación no se aplica a átomos aislados. Sólo se usa para explicar un esquema de enlace en una molécula. | |
|
La hibridación es la mezcla de al menos dos orbitales atómicos no equivalentes, por ejemplo, orbitales s y p. En consecuencia, un orbital híbrido no es un orbital atómico puro (esto es, nativo). Los orbitales híbridos tienen formas muy diferentes de las de los orbitales atómicos. | |
|
El número de orbitales hibridos generados es igual al número de orbitales atómicos puros que participan en el proceso de hibridación. | |
|
La hibridación requiere de energía; sin embargo, el sistema recobra de sobra esta energía al formarse el enlace. | |
|
Los enlaces covalentes en moléculas poliatómicas se forman mediante el traslape de orbitales híbridos, o de orbitales híbridos con orbitales no hibridados. En consecuencia, el esquema de hibridación en el enlace está aún en el contexto de la teoría enlace valencia; se supone que los electrones en una molécula ocupan orbitales híbridos de los átomos individuales. |
La
figura ![]() muestra las hibridaciones sp, sp2 y sp3 (así como otros tipos de hibridaciones) y las formas de los orbitales híbridos.
muestra las hibridaciones sp, sp2 y sp3 (así como otros tipos de hibridaciones) y las formas de los orbitales híbridos.