

La hibridación es la mezcla de orbitales atómicos de un átomo (comúnmente un átomo central) para generar un conjunto de nuevos orbitales atómicos, llamados orbitalos híbridos. Los orbitales híbridos, que son orbitales atómicos que se obtienen cuando dos o más orbitales no equivalentes del mismo átomo se combinan, se usan para formar enlaces covalentes. Se pueden generar cuatro orbitales híbridos mezclando el orbital 2s con los tres orbitales 2p. Como estos orbitales hibridos se formaron a partir de un orbital s y tres orbitales p, se denominan orbitales híbridos sp3 (se lee ese-pe-tres). La figura muestra la forma y orientación de los orbitales híbridos sp3.
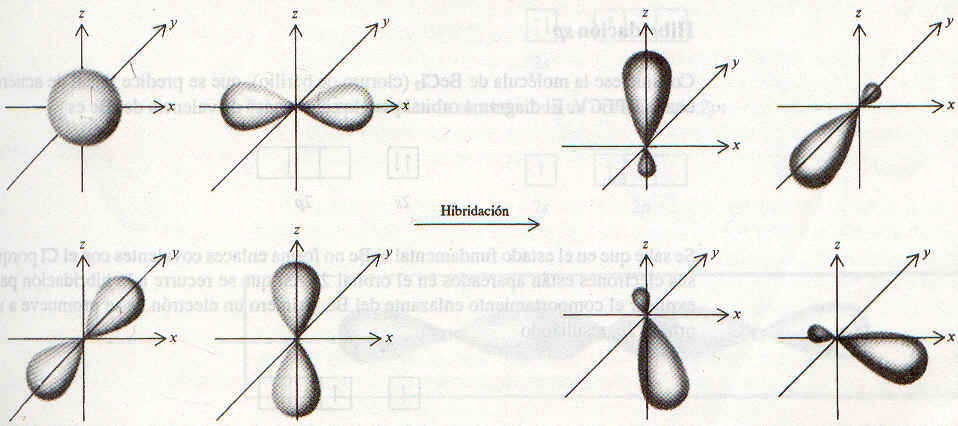 |
Los cuatro orbitales híbridos son equivalentes y se dirigen hacia los vértices de un tetraedro regular. La figura de abajo muestra cómo se traslapan los orbitales hibridos sp3 del carbono y los 1s de los hidrógenos para formar cuatro enlaces covalentes C-H. Así, el metano tiene forma tetraédrica, y todos los ángulos HCH son de 109.5º.
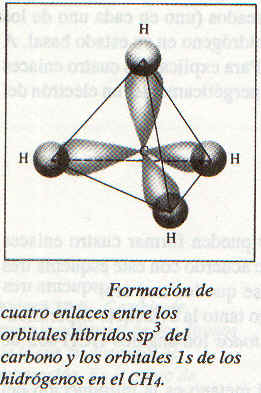 |
Obsérvese que no obstante que se requiere suministrar energía para llevar a cabo la hibridación, esto está más que compensado por la energía liberada en la formación de los enlaces C-H. (La formación de enlaces es un proceso exoténnico.)
El átomo de O en el H20 también tiene cuatro pares de electrones. Así que se puede esperar que el átomo de O también presente hibridación sp3. Sin embargo, la evidencia espectroscópica sugiere fuertemente que los orbitales enlazantes del O (que se usan par formar los enlaces O-H) son orbitales 2p más que orbitales híbridos sp3. Esto significa que el átomo de O en el H20 no está hibridado. Si esto es verdad, cabe preguntar por qué el ángulo HOH no es de 90º dado que los orbitales p son perpendiculares entre sí. La razón es que en la molécula de H20 los dos enlaces O-H necesitan separarse para evitar la aglomeración de los átomos de H en el mismo espacio (situación energéticamente desfavorable). En consecuencia, el ángulo de enlace aumenta con respecto al predicho de 90º a 104.5º.
![]() Hibridación
sp
Hibridación
sp
Considérese la molécula de BeCI2 (cloruro de berilio), que se predice lineal de acuerdo con la RPECV. El diagrama orbital para los electrones de valencia del Be es:
 |
Se sabe que en el estado fundamental el Be no forma enlaces covalentes con el Cl porque sus electrones están apartados en el orbital 2s. Así que se recurre a la hibridación para explicar el comportamiento enlazante del Be. Primero un electrón 2s se promueve a un orbital 2p, resultando
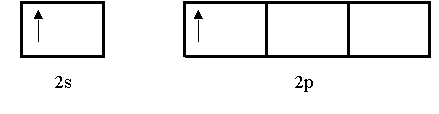 |
Ahora hay dos tipos diferentes de orbitales del Be disponibles para el enlace, el 2s y el 2p.