

![]() Introducción
Introducción
El trabajo de Einstein preparó el caminó para solucionar otro misterio de la Física del siglo XIX, los espectros de emisión de los átomos. Desde el siglo XVII, en que Newton demostró que la luz solar está compuesta por varios componentes coloridos que se pueden recombinar para producir luz blanca, los químicos y los físicos han estudiado las características de los espectros de emisión de varias sustancias, esto es, la radiación emitida por las sustancias ya sea continua o en forma de líneas.
![]() Espectros Continuos y Lineales
Espectros Continuos y Lineales
El espectro de emisión se obtiene suministrando a una muestra de material energía térmica o alguna otra forma de energía (como una descarga eléctrica de alto voltaje, si la sustancia es gaseosa). Por ejemplo, una barra de hierro al "rojo caliente" o "blanco caliente" recién removida de una fuente de alta temperatura brilla de una manera especial. Este resplandor visible es la porción del espectro de emisión que es percibida por el ojo humano. El calor que se siente a la distancia de la misma barra de hierro es otra porción de su espectro de emisión (esta porción es de la región del infrarojo).
|
Una característica del espectro de emisión del Sol y del calentamiento de un sólido caliente es que ambos son continuos; es decir, todas las longitudes de onda de la luz están representadas en el espectro (vea la región visible en la figura).
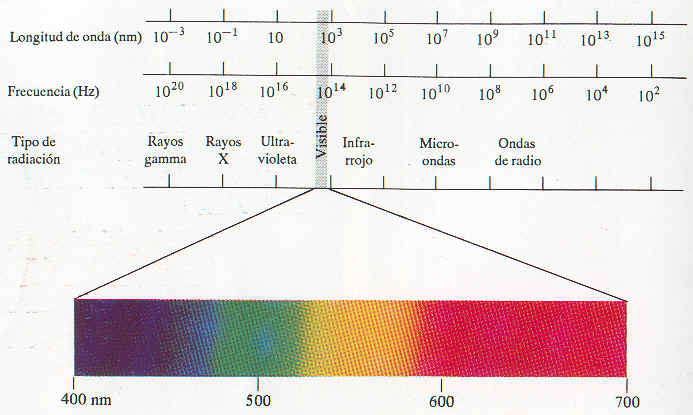 |
Los espectros de emisión de átomos con fase gaseosa, no muestran una distribución continua de longitudes de onda desde el rojo al violeta; en lugar de ello los átomos enmiten luz sólo a longitudes de onda específicas. Dichos espectros se llaman espectros de línea o lineales porque la radiación se identifica por la aparición de líneas brillantes en el espectro. La figura muestra un diagrama esquemático de un tubo de descarga que se utiliza para estudiar los espectros de emisión.
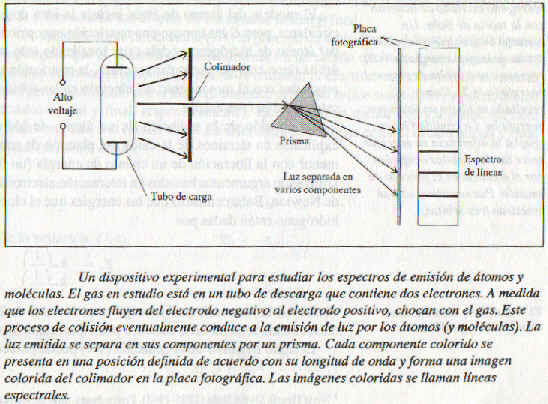 |
Esta figura muestra el color emitido por átomos de hidrógeno en un tubo de descarga.
 |
Cada elemento tiene un espectro de emisión único. Las líneas características de los espectros atómicos se pueden utilizar para identificar átomos desconocidos, así como las huellas digitales sirven para identificar una persona.