

![]() Introducción
Introducción
En 1914, el físico danés Niels Bohr utilizó la teoría cuántica de Planck para explicar el espectro de líneas del hidrógeno. Bohr introdujo la idea de que las absorciones y emisiones de luz del atómo de hidrógeno corresponden a cambios de energía de los electrones dentro de los átomos. Dado que solo son absorbidas o emitidas ciertas frecuencias entonces los cambios de energía dentro de un átomo están cuantizados.
|
Fotografía de Niels Bohr |
El modelo de Bohr para el átomo de hidrógeno incluía dos proposiciones importantes. La primera era la establecida por Rutherford respecto a la naturaleza nuclear del átomo, la otra fue el descubrimiento de Einstein de que la energía radiante se podía considerar como una corriente de conjuntos discretos de enegía denominados fotones. Este modelo aunque no es estrictamento correcto, fué el primero en proponer la cuantización de la energía de los electrónes en los átomos.
 |
El modelo de Bohr consta de una serie de postulados que podemos resumir como sigue:
El electrón de un átomo de hidrógeno se mueve alrededor del protón central en una órbita circular. Solamente están permitidas las órbitas de determinados radios, correspondientes a ciertas energías definidas. Se dice que un electrón en una de estas órbitas está en un estado de energía "permitido". Un electrón en un estado de energía permitido no caerá en espiral hacia el núcleo.
El electrón puede cambiar de un estado de energía permitido a otro, absorbiendo o emitiendo energía radiante. La frecuencia (v), de la energía radiante correspondiente exactamente a la diferencia de energía (DE) entre los estados permitidos de energía es DE=hv, donde h es la constante de Planck.
Bohr fué capaz de calcular un conjunto de energías permitidas para el electrón. Cada una de ellas corresponde a un diferente radio de trayectoria circular. El modelo de Bohr, a cada órbita permitida se la asignó un número entero (n) conocido como número cuántico principal, que puede tener valores de 1 a infinito. El radio de la órbita del electrón en un estado particular de la energía varía con n2.
Radio=n2(5.30 x 10-11m) n=1,2,... (Ec: 1)
Así mientras mayor sea el valor de n, más lejos estará el electrón del núcleo. La energía del electrón depende de la órbita que ocupa:
En=-RH(1/n2) (Ec: 2)
La constante RH de la ecuación anterior se llama constante de Rydberg, tiene el valor de 2.18x10-18 Joules. En la ecuación vemos que la energía del electrón es 2.18x10-18 Joules cuando está en la órbita más cercana al núcleo, n=1.
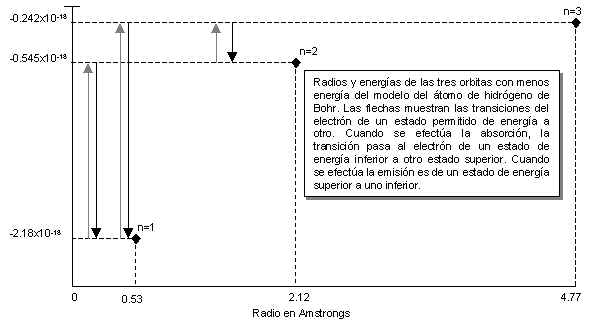
En la siguiente figura se ilustran los radios y las energías de las órbitas para n=1, 2 y 3.
 |
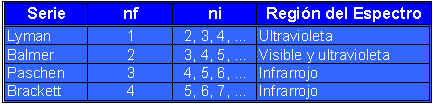
El espectro de emisión del hidrógeno cubre un amplio intervalo de longitudes de onda desde el infrarojo hasta el ultravioleta. La siguiente tabla muestra las series de transición en el espectro de hidrógeno; estas reciben el nombre de sus descubridores.
 |
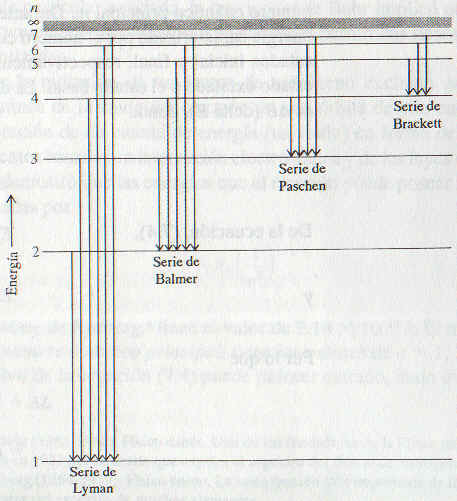
La siguiente figura muestra una transición individual. Sin embargo, es más informativo expresar las transiciones como lo muestra la otra figura. Cada línea horizontal se llama nivel energético. La posición del nivel energético medida en la escala de energía, muestra la energía asociada en un órbita en particular. Las órbitas se identifican por su número cuántico principal.
|
 |
Las energías dadas por la ecuación 2 son negativas. Cuanto más negativa sea la energía más estable será el átomo. El estado de energía más bajo es n=1, este se denomina Estado Basal del Átomo. Cuándo el electrón está en una órbita de energía más elevada (menos negativa) se dice que el átomo está en estado exitado.
Cuándo n se hace infinitamente mayor, el radio se incrementa en la porción n2, llegamos al punto en el cual el electrón está separado completamente del núcleo. La energía para n=infinito se convierte en:
Einfinito=(2.18x10-18J) (1/infinito2)=0
Así, el estado en el cual el electrón se separa del núcleo es el estado de referencia del átomo de hidrógeno y tiene energía cero.
Bohr propuso que las absorciones o las emisiones en el espectro del hidrógeno conrresponden a las transiciones del electrón de una órbita a otra. Se debe absorber energía radiante para que el electrón se mueva de una órbita a otra de radio mayor. A la inversa, se emite energía cuando el electrón pasa de una órbita más alejada a una que tiene radio más pequeño. Los cambios de energía DE estan dados por la siguiente formula:
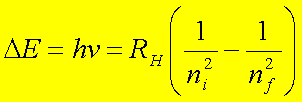 |