

Fueron muchos los intentos a través de la historia para clasificar los elementos que existen sobre la faz de la tierra, la evolución de la tabla periódica, desde la primera ordenación de los elementos, ha tenido lugar a lo largo de más de un siglo de historia y ha ido pareja al desarrollo de la ciencia. Aunque los primeros elementos conocidos, como el oro, el hierro se conocían desde antes de Cristo (recuérdese que el hierro, por su importancia en la evolución de la humanidad ha dado nombre a una época), todavía hoy se investiga la posible existencia de elementos nuevos para añadir a la tabla periódica. A continuación presentamos de manera general las tres principales clasificaciones en la historia.
![]() Triadas
de Döbereiner
Triadas
de Döbereiner
El primer científico que trató de buscar un orden para los elementos conocidos hasta el siglo pasado fue el alemán Johann W. Döbereiner (1780-1849). En 1829 Döbereiner encontró que habían grupos de tres elementos que presentaban un cambio gradual de sus propiedades; además, de que el peso atómico del elemento intermedio era igual al promedio del peso atómico de los elementos que se encuentran en los extremos. Döbereiner llamó tríadas a estos grupos de elementos. A continuación mostramos una tabla que ilustra las triadas de elementos.
| Trada de elementos y pesos atómicos | Forma Elemental | Compuestos Principales | Propiedades Especiales |
| (I)
Cl, Br, I:
35.5, 80, 127 |
Moléculas
diatómicas con color:
Cl2(amarillo) Br2(café) I2 (violeta) |
Sales
en forma simple contienen: iones -1: Cl-,Br-, I-. Oxyaniones contienen de uno a cuatro átomos de oxígeno: ClO4-, ClO3-, BrO3-, IO3-, ClO-, IO4-. Los compuestos de hidrógenos con moléculas: HCl, HBr, HI |
Los
elementos libres reaccionan vigorozamente con electrones que se
donan para formar iones negativos: Cl-, Br-, I-.
2Na + Cl2 Æ 2Na+ + 2 Cl- I2 + S2- Æ 2I- + S Sales (como NaCl)son muy solubles en agua. Sales hálidas (que contien alógeno) de Li, Na, y K dan origen a soluciones neutras. Compuestos de hidrógenos son ácidos fuertes y se ionizan por completo en agua. HBr + H2O Æ H3O+ + Br- |
| (II)
S, Se, Te
32, 79, 127.6 |
No
metales cristalinos con color (Te
es algo metálico): S8(amarillo) Se8 (rojo) |
Sales en forma simple con iones -2: S2-, Se2-, Te2-, y compuestos de mal olor con hidrógeno: H2S, H2Se, H2Te. Oxianiones con más de cuatro átomos de oxígeno: SO32-,a SO42-, *SeO42-. Forman dioxidos y trioxidos SO2, SO3, *SeO2, TeO2, TeO3. | Sales,
excepto aquellas con las triadas III y IV, son ligeramente solubles en
agua:
CuS, ZnS, HgS. Sales solubles (Na2S) dan soluciones
básicas: S2-+ H2O Æ HS- + OH- Compuestos con hidrógeno son ácidos débiles. |
| (III)
Ca, Sr, Ba
40, 88, 137 |
Metales Reactivos | Forman sales que contienen iones +2: Ca2+, Sr2+, Br2+ en BaSO4, CaCO3, SrCl2, y otras más. | Las sales tienen colores brillantes cuando se queman: Ca (naranja), Sr (rojo), Ba (verde). Sulfatos y carbonatos son solubles. Los metales remplazan lentramente hidrogenos del agua. |
| (IV)
Li, Na, K
7, 23, 39 |
Metales muy reactivos | Forman sales que contienen iones +1: Li+, Na+, K+ en Li2CO3, NaCl, K3PO4, y otras más. | Aproximadamente
todas las sales son solubles: los metales y sales tienen colores
brillantes cuando se queman:
Li (rojo), Na (amarillo), K (morado). Los metales reaccionan
violentamente con agua para producir hidrógeno e iones solubles de
hidróxidos:
2Na
+ 2H2O Æ |
*Note la importancia de la carga: SO32- es muy diferente del SO3 (no tiene carga).
![]() Ley
de las Octavas de Newlands
Ley
de las Octavas de Newlands
Años más tarde
(1864), el inglés Johan Alexander
Newlands (1838-1889) ordenó los elementos conocidos de acuerdo con sus
pesos atómicos crecientes; observó que después de colocar siete elementos, en
el octavo se repetían las propiedades químicas del primero; a este
agrupamiento lo llamó ley de las
octavas. La siguiente tabla es una representación de las Octavas de
Newlands, si deseas información más detallda da clic en esta página ![]()
| No. | No. | No. | No. | No. | No. | No. | No.
| H
1
| F
8
| Cl
15
| Co
& Ni 22
| Br
29
| Pd
36
| I
42
| Pt
& Ir 50
| Li
2
| Na
9
| K
16
| Cu
23
| Rb
30
| Ag
37
| Cs
44
| Os
51
| G
3
| Mg10
| Ca
17
| Zn
24
| Sr
31
| Cd
38
| Ba
& V 45
| Hg
52
| Bo
4
| Al
11
| Cr
19
| Y
25
| Ce
& La 33
| U
40
| Ta
46
| Tl
53
| C
5
| Si
12
| Ti
18
| In
26
| Zr
32
| Sn
39
| W
47
| Pb
54
| N
6
| P
13
| Mn
20
| As
27
| Di
& Mo 34
| Sb
41
| Nb
48
| Bi
55
| O
7
| S
14
| Fe
21
| Se
28
| Ro
& Ru 35
| Te
43
| Au
49
| Th
56
| |
|---|
![]() La
Tabla Periódica de Mendeleev
La
Tabla Periódica de Mendeleev
En 1869 el químico ruso Dimitri Mendeleev propuso una nueva clasificación de los elementos que superó grandemente la de Newlands sobre todo en dos aspectos. Primero, agrupó juntos a los elementos en forma más exacta de acuerdo con sus propiedades.
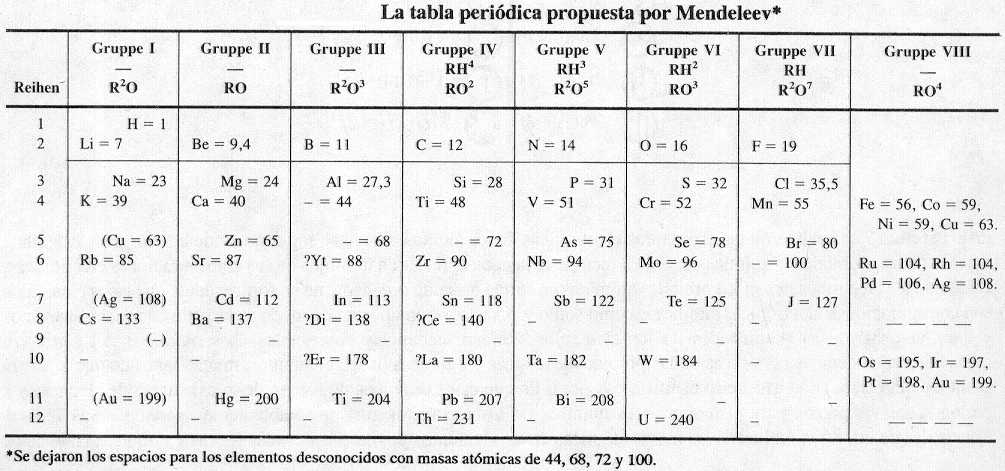 |
De igual importancia fue el hecho de que hizo posible la predicción de las propiedades de varios elementos que aún no habían sido descubiertos. Por ejemplo, Mendeleev propuso la existencia de un elemento desconocido que llamó eka-aluminio. ("Eka" proviene del sánscrito, palabra que significa "primero"; así eka-aluminio sería el primer elemento bajo el aluminio en el mismo grupo.) Cuando el galio fue descubierto cuatro años más tarde, se encontró que las propiedades predichas para el eka-aluminio coincidían notablemente con las observadas en el galio (ver tabla).
 |
Utilizando como criterio la valencia de los distintos elementos, además de su peso atómico, Mendeliev presentó su trabajo en forma de tabla en la que los periodos se rellenaban de acuerdo con las valencias (que aumentaban o disminuían de forma armónica dentro de los distintos periodos) de los elementos. Esta ordenación daba de nuevo lugar a otros grupos de elementos en los que coincidían elementos de propiedades químicas similares y con una variación regular en sus propiedades físicas. La tabla explicaba las observaciones de Döbereiner, cumplía la ley de las octavas en sus primeros periodos y coincidía con lo predicho en el gráfico de Meyer. Además, observando la existencia de huecos en su tabla, Mendeliev dedujo que debían existir elementos que aun no se habían descubierto y además adelanto las propiedades que debían tener estos elementos de acuerdo con la posición que debían ocupar en la tabla. Años más tarde, con el descubrimiento del espectrógrafo, el descubrimiento de nuevos elementos se aceleró y aparecieron los los que había predicho Mendeliev. Los sucesivos elementos encajaban en esta tabla. Incluso la aparición de los gases nobles encontró un sitio en esta nueva ordenación. La tabla de Mendeliev fue aceptada universalmente y hoy, excepto por los nuevos descubrimientos relativos a las propiedades nucleares y cuánticas, se usa una tabla muy similar a la que él elaboró más de un siglo atrás.