

Numerosas propiedades físicas, incluyendo la densidad, el punto de fusión y el punto de ebullición, están relacionadas con el tamaño de los átomos, pero el tamaño atómico es difícil de definir. La densidad electrónica en el átomo se extiende más allá del núcleo. En la práctica, por lo general se piensa en tamaño atómico como el volumen que contiene un 90% de la totalidad de la densidad electrónica alrededor del núcleo.
Varias técnicas permiten estimar el tamaño de un átomo. Considérese en primer lugar los elementos metálicos. La estructura de los metales es muy variada, pero todos ellos comparten una característica: sus átomos están enlazados uno a otro en una extensa red tridimensional. Así es que el radio atómico de un metal es la mitad de la distancia entre dos núcleos de dos átomos adyacentes [ver figura]. Para elemenios que existen como moléculas dialómicas simples, el radio atómico es la mitad de la distancia entre los núcleos de los dos átomos en una molécula específica [ver figura].
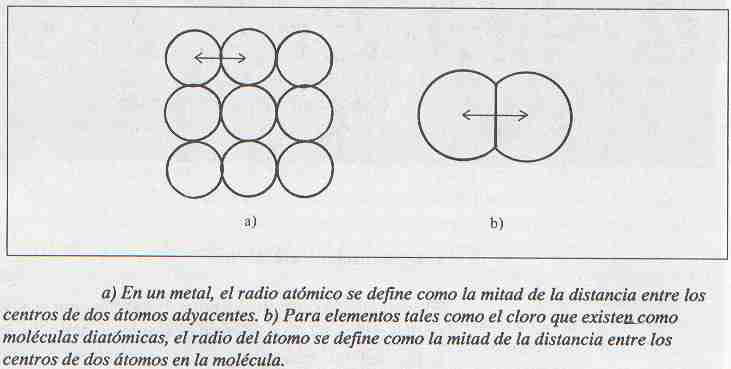 |
La figura del icono ![]() muestra el radio de muchos elementos de acuerdo con su posición en la tabla
periódica.
muestra el radio de muchos elementos de acuerdo con su posición en la tabla
periódica.
Las tendencias periódicas son evidentes. Al estudiar las tendencias conviene tener en mente que los radios atómicos están determinados en gran medida por cuán fuertemente atrae el núcleo a los electrones. A mayor carga nuclear efectiva, los electrones estarán más fuertemente enlazados al núcleo y menor será el radio atómico. Considérese el segundo periodo de elementos del Li al F. Al desplazarse de izquierda a derecha, se encuentra que el número de electrones de la carga interna (ls2)permanece constante, mientras que la carga nuclear aumenta. Los electrones que se agregan para balancear la creciente carga nuclear efectiva aumenta constantemente mientras que el número cuántico principal permanece constante (n = 2). Por ejemplo, el electrón externo 2s del litio es "protegido" del núcleo (que tiene 3 protones) por los dos electrones ls. Como una aproximación, se puede suponer que el efecto de apantallamiento de los dos electrones ls cancela dos cargas positivas del núcleo. Entonces el electrón 2s sólo siente la atracción debida a un protón en el núcleo, o la carga nuclear efectiva es + 1.
A medida que se desciende en un grupo (por ejemplo, el grupo 1A) se encuentra que el radio atómico aumenta según aumenta el número atómico. Para los metales alcalinos la carga nuclear efectiva sobre el electrón más externo permanece constante (+ 1) pero n crece. Como el tamaño de los orbitales aumenta con el incremento del número cuántico principal n, el tamaño de los átomos metálicos aumenta del Li al Cs. El mismo razonamiento se puede aplicar a los elementos de los otros grupos.