

La energía de red de un compuesto es la energía que se requiere para separar un mol de la sustnacia iónica sólida, en sus iones gaseosos. Por ejemplo:
NaCl(g)
---> Na+(g) + Cl-(g)
Energía de Red = +788 kJ/mol
El elevado valor de la energía de red para el NaCl(s) explica el hecho de que el cloruro de sodio es una sustancia sólida estable, con un elevado punto de fusión. En la tabla se enumera las energías de red de algunos compuestos iónicos. Vemos que todas estas energías son valores positivos grandes, indicando que los iones están atraidos fuertemente uno al otro en estos estados sólidos. Debido a esta fuerte atracción, la mayor parte de las sustancias iónicas son sólidos duros, frágile y con elevados puntos de fusión.
| Energías de Red para algunos compuestos iónicos | |
| Compuesto | Energía
de Red kJ/mol |
| LiF | 1024 |
| LiI | 744 |
| NaF | 911 |
| NaI | 693 |
| KF | 815 |
| KI | 641 |
| MgF2 | 2910 |
| SrCl2 | 2130 |
| MgO | 3938 |
Las energías de red son grandes y positivas debido a la atracción entre los iones positivo y negativo. La energía potencial (Ep), de las dos partículas cargadas que interactúan esta dada por:
En esta ecuación, Q1 y Q2 son las cargas de las partículas en coulombs y d es la distancia entre sus centros en metros. La constante k tiene el valor de 8.99x109 J-m/C2. Si las cargas tienen el mismo signo, Ep es mayor que cero, lo que indica que la energía potencial se incrementa a medida que los iones se aproximan unos a otros. Este incremento representa la repulsión entre partículas de carga semenjante. Del mismo modo, cuando las cargas tienen el signo opuesto, Ep es negativa, indicando que la energía potencial decrece a medida que los iones se aproximan unos a otros. Esta disminución en la energía potencial representa la atracción entre partículas de carga opuesta.
En el cloruro de sodio (como se muestra en la figura de abajo), cadio ión de Na+ esta rodeado por seis iones de Cl-, y cada ión de Cl- esta rodeado por seis iones de Na+. Desde luego, cada ión Na+ esperimenta una repulsión de los otros iones de Na+ en la red, pero estos iones están alejados pues sus "vecinos más cercanos" son los iones de Cl-. Estos iones de Cl- también se repelen entre si.
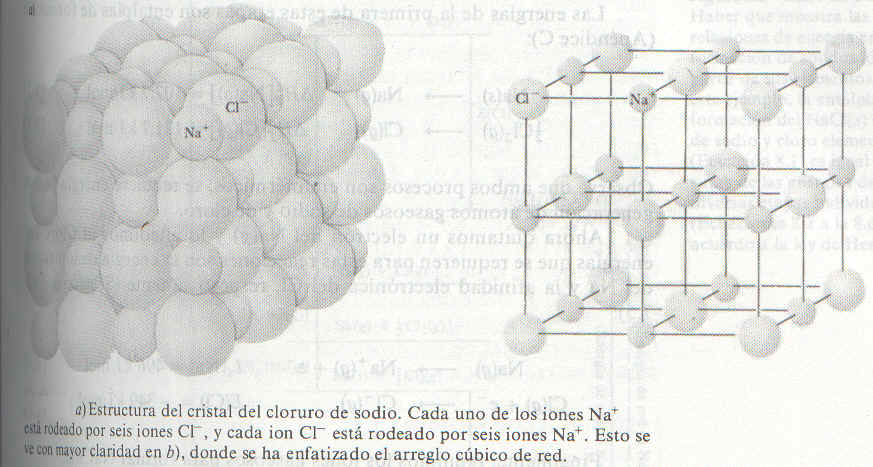 |
La energía de red es el resultado de todas la atracciones y repulsiones electrostáticas entre los iones que hay en la red. La energía de Red es muy gran debido a que las atracciones entre los iones de carga opuesta sobrepasan las repulsiones iones de carga semejante. Las energías de red son positivas debido a que representan la energía que se debe suministrar a fin de separar los iones de un cristal en iones gaseosos.
En la ecuación anterior se indica que la atracción entre dos iones de cargas opuestas se incrementa a medida que sus cargas se incrementan y a medida que la distancia entre sus centros disminuye. Así, para un arreglo determinado de iones, la energía de red aumenta a medida que las cargas de los iones aumentan y tambien a medida de que los radios disminuyen. La magnitud de las energías de red dependen principalmente de las cargas iónicas por que los radios iónicos no varian apreciablemente.