

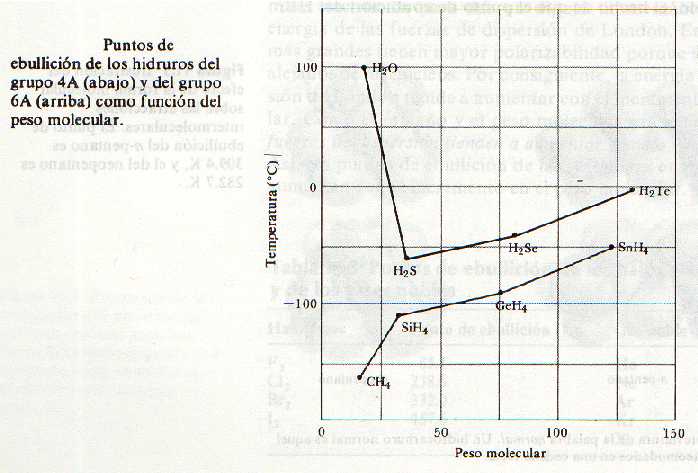
En la figura se muestran los puntos de ebullición de los hidruros simples de los elementos de los grupos 4A y 6A. En general, los puntosde ebullición se elevan con el incremento en peso molecular, debido a las mayores fuerzas de dispersión. La excepción notable de esta tendencia es H20, cuyo punto de ebullición es mucho más elevado de lo que se podría esperar considerando su peso molecular. El NH3 y el HF también tienen puntos de ebullición anormalmente elevados. Estos compuestos tienen muchas otras características que los distinguen de otras sustancias de peso molecular y polaridad similares. Por ejemplo, el agua tiene un elevado punto de fusión, una elevada capacidad calorífica por gramo y un elevado calor de evaporación. Cada una de estas propiedades indica que las fuerzas intermoleculares de H20 son excepcionalmente intensas.
 |
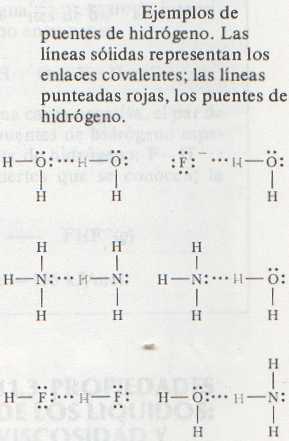
Estas atracciones intermoleculares se deben a los puentes de hidrógeno. El puente de hidrógeno es un tipo especial de atracción intermolecular que existe entre el átomo de hidrógeno de un enlace polar (sobre todo un H-F, H-0, ó H-N) y un par de electrones no compartido en un átomo electronegativo (F, O, N) de una molécula vecina. Por ejemplo, hay un puente no entre el átomo de H de una molécula de HF y el átomo de F de la molecula adyacente de HF, F-H ... F-H (donde los puntos representan el puente de hidrógeno entre las moléculas). En la figura siguiente se presentan varios ejemplos adicionales.
 |
Los puentes de hidrógeno se pueden considerar como un tipo de dipolo-dipolo. Debido a que F, N, y O, son muy electronegativos, entre el hidrógeno y cualquiera de estos tres elementos es muy polar y el hidrógeno queda en el extremo positivo:
| <-----+- | <-----+- | <-----+- |
| N----H | O----H | F----H |
El átomo de hidrógeno no tiene electrones inferiores. Por tanto, el extremo del dipolo del enlace tiene la carga concentrada en el protón, parcialmente expuesto en el núcleo de hidrógeno. Esta carga positiva es hacia la carga negativa de un átomo electronegativo de una molécula cercana. Debido a que el hidrógeno pobre en electrones es tan pequeño se puede aproximar mucho a un átomo electronegativo y ser por él con fuerza.
La energía de los puentes de hidrógeno varia de 4 kJ/mol a 25 kJ/mol aproximadamente. Así, son mucho más débiles que los enlaces químicos ordinarios. A pesar de ello, el puente de hidrógeno es más fuerte que las fuerzas dipolo-dipolo o que las de dispersión; esto tiene importantes para las propiedades de muchas sustancias, incluyendo las de los sistemas biológicos.
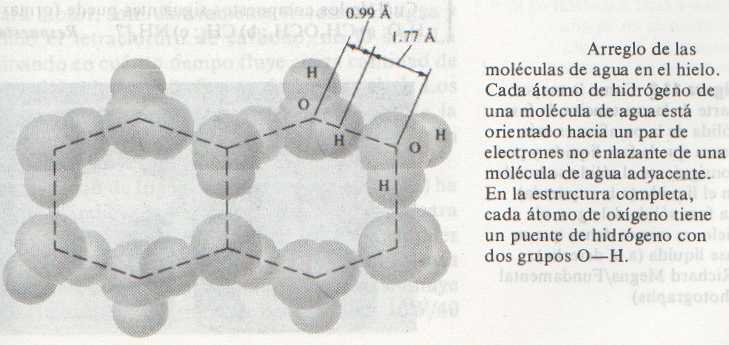
El puente de hidrógeno es responsable, por ejemplo, de la estructura compacta del hielo (Figura de abajo), que es causa de que el hielo tenga una densidad inferior a la del agua líquida.
 |