

Los alcanos tietien la fórmula general CnH2n+2, donde n=1, 2, ... La característica esencial de las moléculas de hidrocarburos alcanos es que sólo presentan enlaces covalentes sencillos. Se dice que los enlaces están saturados en estos compuestos. Así que los alcanos se conocen como hidrocarburos saturados.
El miembro más simple de la familia (esto es, con n = 1) es CH4, que se encuentra naturalmente en la descomposición bacteriana anaeróbica de materia vegetal subacuática. Como se recolectó por primera vez en los pantanos, el metano llegó a conocerse como "gas de los pantanos". Las termitas constituyen una fuente bastante inverosímil pero comprobada del metano. Cuando estos voraces insectos consumen madera, la celulosa (el componente principal de la madera) es degradada por los microorganismos que habitan en su sistema digestivo a metano, dióxido de carbono y otros compuestos. Se calcula que las termitas producen anualmente 170 millones de toneladas de metano. Tambien se produce en algunos procesos de tratamiento de desechos.
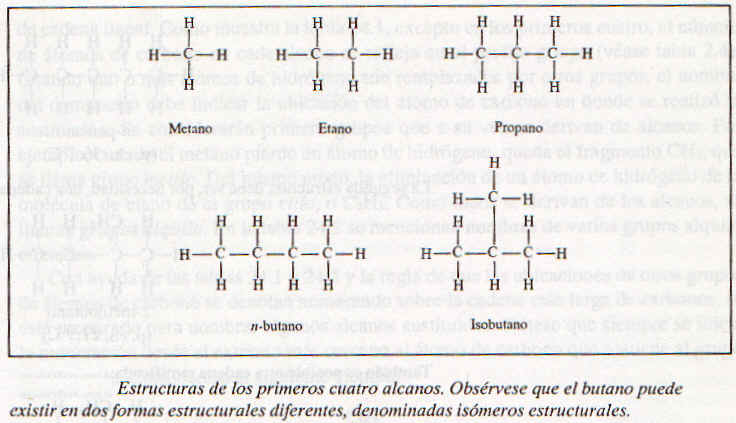
La figura muestra las estructuras de los primero cuatro alcanos (esto es, de n=1 a n=4). El gas natural es una mezcla de metano, etano y una pequeña cantidad de propano. En realidad se puede suponer que los átmos de carbono en todos los alcanos presentan hibridación sp3. Las estructuras del etano y el propano son únicas, dado que solo hay una forma de unir los átmos de carbono en estas moléculas. El butano, sin embargo, tiene dos posibilidades esquemas de enlace y puede existir como dos isómeros estructurales denominados n-butano (la n indica normal) e isobutado. Los isómeros estructurales son moléculas que tienen la misma fórmula molecular pero diferente estructura.
 |
En la serie de los alcanos, a medida que aumenta el número de átomos de carbono, se incrementa rapidamente el número de isómeros estructurales. Por ejemplo, el butano tiene dos isómeros, el decano, C10H22, tiene 75 isómeros; y el alcano C30H62 ¡tiene más de 400 millones de isómeros! Obviamente, la mayoría de estos isómeros no existe en la naturaleza ni se ha sintetizado. De cualquier manera, los números ayudan a explicar por que el carbono se encuentra en muchos más compuestos que cualquier otro elemento.
La siguiente tabla muestra los puntos de fusión y ebullición de los isómeros de cadena lineal de los primero 10 alcanos. Los primeros son gases a temperatura ambiente; y del pentano a decano son líquidos. Al aumentar el tamaño molecular, se incrementa el punto de ebullición, porque aumentan las fuerzas de dispersión.
 |