

Existen algunos tipos de reacciones en las que dos reactivos no producen un solo producto, sino una mezcla. Dichos ejemplos incluyen la halogenación de alcanos, la adición a dobles enlaces y la sustitución electrofilica aromática, en las que se puede formar más de un isómero a partir de los mismos dos reactivos. Incluso en la sustitución nucleofílica se puede formar más de un producto. Por ejemplo, la hidrólisis de un solo bromuro de alquilo produce una mezcla de dos alcoholes. Pero algunas veces se observa que pueden ocurrir dos tipos de reacción completamente diferentes al mismo tiempo, entre los dos mismos reactivos, y forman dos (o más) clases de productos totalmente diferentes. Analicemos un ejemplo.
Cuando un halogenuro de alquilo que tiene un hidrógeno unido al carbono adyacente a aquel que está unido al halógeno reacciona con un nucleófilo son posibles dos caminos de reacciones en competencia: sustitución y eliminación.
 |
En la reacción de sustitución, el nueleófilo remplaza al halógeno X. En la reacción& eliminación, el nucleófilo actúa como una base y remueve un protón del carbono 2 que es el carbono vecino al que está unido al hálógeno X. Se eliminan el halógeno X y el hidrógeno del carbono adyacente, para formar un nuevo enlace (un enlace pi) entre los carbonos 1 y 2. Se utiliza el símbolo E para designar un proceso de eliá- nación. Debido a que, en este caso, se elimina un halogenuro de hidrógeno, la reacción recibe el nombre de deshidrohalogenación. Las reacciones de eliminación constituyen una forma útil para preparar compuestos con dobles o triples enlaces.
Con frecuencia ocurren simultáneamente las reacciones de sustitución y eliminación con el mismo tipo de reactivos -un nucleófilo y un sustrato-. Puede predominar un tipo de reacción o el otro, lo que depende de la estructura del nueleófilo, de la estructura del sustrato así como de otras condiciones de reacción. Lo mismo que con las reacciones de sustitución, hay dos mecanismos importantes para las reacciones de eliminación, designados como E2 y El. Antes de aprender cómo controlar estas reacciones, debemos entender sus mecanismos.
Al igual que en el mecanismo SN2, el mecanismo E2 es un proceso en un paso. El nueleófilo, al actuar como una base, remueve el protón (hidrógeno) de un átomo de carbono adyacente al que está unido al grupo saliente. Al mismo tiempo, el grupo saliente se separa y se forma un doble enlace. Las flechas curvas muestran la ruptura y la formación de los enlaces que ocurren durante una reacción E2.
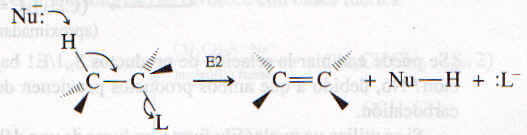 |
En la ecuación anterior se muestra la conformación preferida por el sustrato en una reacción E2. Los átomos H-C-C-L se encuentran en el mismo plano, con el H y el L acomodados de forma transoide o anti. La razón de esta preferencia es que los enlaces C-H y C-L se encuentran en una conformación paralela. Es necesario este alineamiento para formar el nuevo enlace pi a medida que se rompen los enlaces C-H y C-L.
El mecanismo E1 es un proceso en dos pasos y su primer paso es el mismo que en el mecanismo SN1, la ionización del sustrato para formar el carbocatión, que es lenta y determinante de la velocidad
 |
Por lo tanto, son posibles dos reacciones para el carbocatión. Puede combinarse con un nucleófilo (proceso SN1) o bien perder un protón de un átomo de carbono adyacente al carbono positivo, como lo muestra la flecha curva, para formar un alqueno (proceso E2).
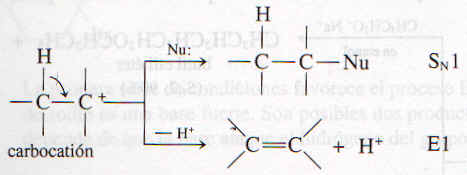 |
[Atrás]|[Indice]|[Adelante]