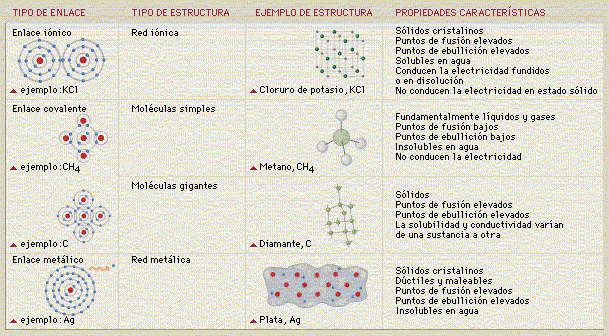
De acuerdo al tipo de átomo que participan en los enlaces químicos, éstos se clasifican de la siguiente manera:
| Enlace Iónico o Electrovalente: Enlace formado por las atracciones electrostáticas entre iones formados por una trasferencia de electrones. Ejemplo: |
| Enlace Covalente: Enlace entre átomos por compartición de un par de electrones. Ejemplo: Cl2 |
| Enlace Metálico: Unión entre átomos en la cual éstos están dispuestos en estructuras compactas tridimensionales. Los electrones exteriores de estos átomos se pueden mover a lo largo de la estructura y la mantienen unida. Ejemplo: Fe. |
Dentro del Enlace Covalente se pueden citar tres subdivisiones:
Enlace
Covalente No Polar o Puro: El par de electrones se distribuye
equitativamente entre los átomos. Ejemplo: I2| Enlace
Covalente Polar: El par de electrones no se encuentra distribuido
equitativamente entre los átomos. Ejemplo: H:F | Enlace
Covalente Coordinado: Uno de los átomos “dona” el par de electrones para formar
el enlace. Ejemplo: Amoníaco que se protona para formar ión amonio. | |
Basado en la diferencia de electronegatividad entre los átomos que forman el enlace puede predecirse el tipo de enlace que se formará:
Si
la diferencia de electronegatividades es mayor que 2, se formará un enlace
íonico
| Si
la diferencia de electronegatividades es mayor que 0.5 y menor a 2.0, el
enlace formado será covalente polar.
| Si
la diferencia de electronegatividades es menor a 0.5 el enlace será
covalente puro (o no polar). | |
Ejemplo:
¿Qué tipo de enlace se formará entre H y O?
Según la Tabla de Electronegatividades de Pauli, el Hidrógeno tiene una Electronegatividad de 2.2 y el Oxígeno 3.44, por lo tanto la diferencia de electronegatividades será:
3.44 - 2.2 = 1.24
1.24 es menor que 2.0 y mayor que 0.5. Por lo tanto, el enlace será Covalente Polar.
El comportamiento químico de los sólidos, líquidos y gases que nos rodean está determinado por las formas en que los átomos se unen entre sí, lo que a su vez depende de las interacciones entre sus electrones más externos. Los electrones pueden transferirse de un átomo a otro (enlace iónico), compartirse entre átomos vecinos (enlace covalente) o moverse libremente de átomo en átomo (enlace metálico). El moderno conocimiento de la estructura y comportamiento de la materia a escala atómica explica con éxito las propiedades de la materia a gran escala. La siguiente tabla muestra un resúmen muy ilustrativo de los tres tipos de enlaces que existen: