

A distancias muy cortas dos átomos cualesquiera muestran una débil interacción de enlace debido a sus cargas eléctricas fluctiantes. Sin embargo, si los dos átomos están muy cercanos, se repelen mutuamente con mucha fuerza.
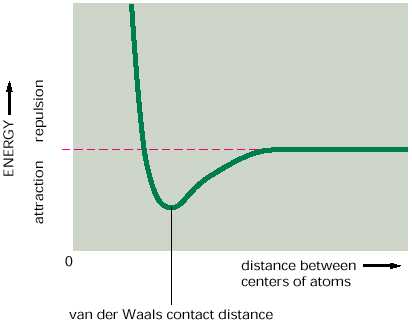 |
| En la gráfica podemos observar que existe un punto en que debido a la distancia entre los dos átomos se presenta la fuerza de Van der Waals y que al disminuir la distancia los átomos se repelen con mucha fuerza. |
Entonces podemos definir que las fuerzas de Van der Waals son enlaces muy débiles (generalmente no mayores de 1 kcal/mol) formados entre moléculas no polares o partes no polares de una molécula.
Cada átomo tiene un "tamaño" característico o un radio de Van del Waals, la distancia de contácto entre dos átomos es la suma de sus radios de Van der Waals.
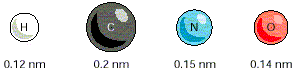 |
|
Radios de Van der Waals de algunos elementos químicos |
Dos átomos serán atraidos mutuamente por las fuerzas de Van der Waals hasta que la distancia entre ellos sea igual a la suma de sus radios de Van der Waals. Aunque individualmente sea muy débiles, las fuerzas de Van der Waals pueden ser importantes cuando dos superficies macromoleculares estan muy juntas.