

![]() Reacciones
de los alcanos
Reacciones
de los alcanos
Los alcanos por lo general no se consideran sustancias muy reactivas. Sin embargo, en condiciones adecuadas pueden llevar a cabo diversas tipos de reacciones, incluyendo la combustión. El quemado del gas natural, de la gasolina y del petróleo implica la combustión de los alcanos. Todas estas reacciones son altaríiente exotérinicas:
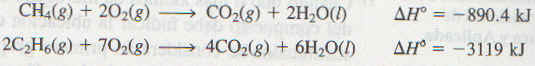 |
Éstas, y reacciones similares, se han usado por mucho tiempo en procesos industriales y en la calefacción doméstica y para cocinar.
La halogenación de los alcanos -esto es, la sustitución de uno o más átomos de hidrógeno por átomos de halógeno- es otra clase de reacción bien estudiada. Cuando una mezcla de metano y cloro se calienta a más de 100ºC o se irradia con luz de longitud de onda apropiada, se produce el cloruro de metilo:
 |
Si el cloro gaseoso está presente en cantidad suficiente, la reacción puede continuar:
 |
Una buena parte de la evidencia experimental sugiere que la etapa inicial de la primera reacción de halogenación se lleva a cabo de la siguiente manera:
Así el enlace covalente del Cl2 SC rompe y se forman dos átomos de cloro. Se sabe que el enlace Cl-Cl se rompe cuando se calienta o irradia la mezcla porque la energía de enlace del Cl2 es 242.7 kJ/mol, mientras que se requieren unos 414 kJ/mol para rormper los enlaces C-H del CH4.
Un átomo de cloro libre contiene un electrón desapareado, que se ve como un punto solo. Estos átomos son sumamente reactivos y atacan las moléculas de metano de acuerdo con la ecuación:
Esta reacción produce cloruro de hidrógeno y el radical Metilo ·CH3. El radical metilo es otra especie reactiva; se combina con el cloro molecular para dar cloruro de metilo y un átomo de cloro:
En la misma forma se pueden explicar la producción de cloruro de metilieno y las reacciones subsecuentes a partir del cloruro de metilo. El mecanismo real es más complejo que el esquema que se ha mostrado porque a menudo se producen "reacciones secundarias" que no conducen a los productos deseados, como:
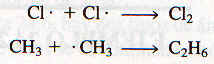 |
Los alcanos en los que se han sustituido uno o más átomos de hidrógeno por un átomo de halógeno se llaman alqui halogenuros. Entre el gran número de alqui halogenuros, los mejor conocidos son el cloroformo (CHCl3), el tetracloruro de carbono (CCl4), el cloruro de metileno (CH2Cl2), y los clorofluorohidrocarburos.
El cloroformo es un líquido volátil, de sabor dulce, se usó por muchos años como anestésico. Sin embargo, en virtud de su toxicidad -puede producir daño severo en el hígado, los riñones y el corazón- ha sido sustituido por otro compuesto. El tetracloruro de carbono, también una sustancia tóxica, sirve como líquido limpiador, pues quita manchas de grasa de la ropa. El cloruro de metileno se usa como disolvente para descafeinar el café y removedor de pintura.