

En el método del ion-electrón (ó Método de las Semireacciones) se balancean las ecuaciones en forma separada y completa describiendo semirreacciones de oxidación y de reducción. A continuación, se iguala el número de electrones que se ganan y se pierden en ambas. Por último, se suman las semirreacciones resultantes para obtener la ecuación total balanceada. De tal forma, se indica el procedimiento general.
Escriba la ecuación general sin balancear en forma tan completa como sea posible.
Construya semirreacciones no balanceadas de oxidación y de reducción (éstas suelen ser incompletas y están sin balancear). Indique fórmulas completas para iones y moléculas poliatómicas.
Balance por inspección todos los elementos de cada semireacción con excepción de H y O. Después, use el diagrama siguiente para balancear el H y el O en cada semirreacción.
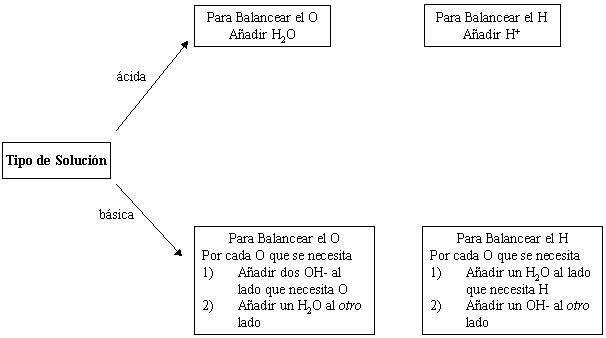 |
Balancee la carga de cada semirreacción añadiendo electrones en forma de "productos" o "reactivos".
Balancee la transferencia de electrones multiplicando las semirreacciones balanceadas por los enteros adecuados.
Sume las semirreacciones resultantes y elimine los términos comunes para obtener la ecuación balanceada.
![]() Ejemplo
Ejemplo
En un procedimiento analítico de gran utilidad se oxidan los iones yoduro para obtener yodo libre. Entonces, se titula este último con solución estándar de tiosulfato de sodio, Na2S2O3. El yodo oxida los iones S2O32- a iones tetrationato, S4O62- o se reduce a iones I1-. Escriba la ecuación iónica neta para esta reacción.
Solución
Se escribe la ecuación en forma tan completa como sea posible. A continuación, se construyen las semirreacciones adecuadas aplicando las reglas descritas:
| I2 + S2O3- ---> I- + S4O62- | Ecuación simple |
| I2
---> I- I2 ---> 2I- |
Semireacción de reducción |
| I2 + 2e- ---> 2I- | Semireacción balanceada |
| S2O32-
---> S4O62- 2S2O32- ---> S4O62- |
Semireacción de oxidación |
| 2S2O32- ---> S4O62- + 2e- | Semireacción de oxidación balanceada |
Cada semireacción tiene dos electrones. Estas semireacciones pueden sumarse por término cancelando los electrones y así obtenemos la reacción balanceada.
 |