

Un método sencillo para balancear ecuaciones de oxidación-reducción, llamado método del número de oxidaxión o Redox,es igualar cualquier aumento en el número de oxidación con una disminución correspondiente al mismo. Por ejemplo, considere el proceso a alta temperatura mediante el cual se utiliza el aluminio para reducir la pirolusita, un mineral de manganeso, a manganeso metálico. La ecuación sin balancear para el proceso es:
Primero asignamos los números de oxidación de todos los elementos de la reacción
 |
Ahora podemos apreciar los cambios en el número de oxidación al pasar de los reactivos a los productos. El estado de oxidación de Al se incremento en 3 y el del Mn decrece en 4.
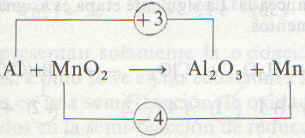 |
Ahora debemos escoger coeficientes que satisfagan los requerimientos de que el incremento total en el estado de oxidación del aluminio sea igual a la disminución total en el estado de oxidación del manganeso:
Para balancear estos cambios, necesitamos 4 átomos de Al por cada 3 áomos de Mn: 4 x 3 = 3 x 4. Esto nos da:
Ahora ya podemos completar el proceso de balanceo por inspección de cada metal. Necesitamos un coeficiente 2 antes de Al2O3 y un coeficiente de 3 antes de Mn:
Observe que al balancear los átomos metálicos, se balancean automáticaente los átomos de olxígeno.
El procedimiento para balancear una ecuación de oxidación-reducción por el método del número de oxidación, se resume como sigue:
Escriba la ecuación no balanceada.
Asigne números de oxidación y determine qué elementos sufren cambios en su número de oxidación durante la reacción.
Escoja coeficientes que hagan que el incremento en el número de oxidación para las sustancias oxidadas iguale a la disminución los los números de oxidación para las sustancias reducidas.
Balancee los elementos restantes por inspección.