

![]() Introducción
Introducción
Los números cuánticos permiten analizar con más profundidad los orbitales atómicos de los átomos de hidrógeno, de helio y de átomos polielectrónicos. La siguiente tabla muestra la relaciones entres los números cuánticos y los orbitales atómicos.
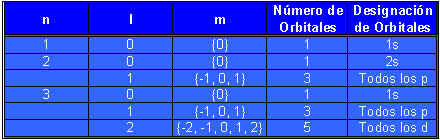 |
Se ve que cuando l=0, (2l + 1) = 1 y hay un solo valor de m, y entonces se tiene un orbital s. Cuando l=1, (2l + 1) = 3 y hay tres valores de m o hay tres orbitales p, llamados px, py y pz. Cuando l=2, (2l + 1) = 5 hay cinco valores de m y los correspondientes cinco orbitales d se identifican por indices más elaborados. A continuación examinaremos los orbitales s, p y d por separado.
![]() Orbitales s
Orbitales s
Una pregunta que surge al estudiar los orbitales es "¿Qué forma tiene un orbital?". En rigor, un orbital no tiene forma bien definida pues la función de onda que lo caracteriza se extiende del núcleo hasta el infinito. En este sentido es difícil decir cómo se ve un orbital.
Aunque en un principio un electrón puede estar en cualquier lugar, se sabe que la mayor parte del tiempo esta cerca del núcleo, por lo que se puede dibujar un diagrama de controno limite que englobe el 90% de la densidad electrónica de un orbital y se puede tener una representación de los orbitales. Las figura muestra diagramas de contorno para los orbitales atómicos 1s, 2s y 3s del hidrógeno.
 |
Todos los orbitales s tienen forma esférica pero difieren en tamaño al aumentar el número cuántico principal.
![]() Orbitales p
Orbitales p
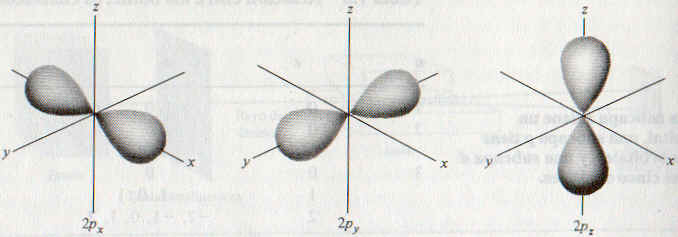
Debe quedar claro que los orbitales p comienzan con el número cuántico principal n=2. Cuando l=1, el número cuántico magnético tiene tres valores -1, 0, 1; empezando con n=2 y l=1 tenemos tres orbitales 2p: 2px, 2py y 2pz. La letra subíndice indica el eje a lo largo del cual se encuentra orientado el orbital. Estos tres orbitales son idénticos en tamaño, forma y energía, solo difieren en su orientación.
La figura muestra los diagramas de contorno para cada orbital p que se pueden imaginar como dos lóbulos; el núcleo esta en el centro del orbital p. Al igual que los orbitales s, los orbitales p aumentan en tamaño de 2p a 3p a 4p y así sucesivamente.
 |
![]() Orbitales d y de mayor energía
Orbitales d y de mayor energía
Cuado l=2 hay 5 valores de m, que corresponden a cinco orbitales d. El valos mínimo de n para un orbital d es de n=3. Como l nunca puede ser mayor de n-1, cuando n=3 y l=2 se tienen los cinco orbitales 3d (3dxy, 3dyz, 3dxz, 3dx2- y
2 y 3dz2), que se muestran en la figura.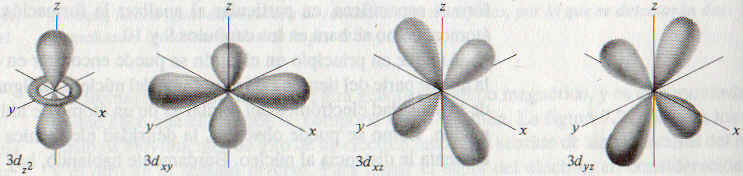 |
Todos los orbitales 3d de un átomo tienen la misma energía. Los orbitales d para un número n>3 tienen formas similares.
Más allá de los orbitales d están los orbitales f, g,... Los orbitales f son importantes para explicar el comportamiento de los elementós con número atómico mayor de 57 a pesar de que sus formas son difíciles de representar.