

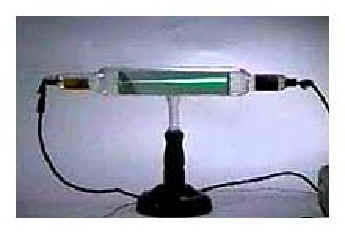
A finales del siglo XIX, J.J. Thomson utilizó un tubo de rayos catódicos y sus conocimientos acerca de los efectos de las fuerzas eléctrica y magnética en una partícula cargada negativamente para obtener la relación entre la carga eléctrica y la masa de una partícula cargada negativamente. Así el 30 de abril de 1897, Thompson anunció el descubrimiento del electrón.
 |
![]() ¿Los átomos están divididos?
¿Los átomos están divididos?
Thomson sugirió que si. Él superó la idea que los rayos catódicos son secuencias de pedazos muy pequeños de átomos. Tres experimentos lo condujeron a esto.
 |
![]() Primer experimento
Primer experimento
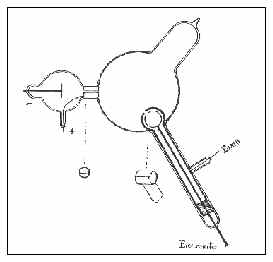
Variando el experimento de 1895 de Jean Perrin, Thomson construyó un tubo de rayos catódicos con cilindros de metal en los extremos y una pequeña hendidura en ellos. Estos cilindros alternadamente fueron conectados con un electrómetro, un dispositivo para coger y medir la carga eléctrica. Perrin había encontrado que los rayos catódicos depositaron una carga eléctrica. Thomson deseó ver si, inclinando los rayos con un imán, él podría separar la carga de los rayos. Él encontró que cuando los rayos entraban en la hendidura de los cilindros, el electrómetro midió una cantidad grande de carga negativa. El electrómetro no hubiera registrado mucha carga si los rayos estuvieran inclinados, por lo que no podrían entrar por la fisura. De acuerdo a estas observaciones, la carga negativa y los rayos catódicos se deben estar de alguna manera juntos: usted no puede separar la carga de los rayos.
Gráfico esquemático del aparato usado en el primer experimento de Thomson. Los rayos catódicos pasan del tubo arriba a la izquierda en el bulbo más grande, donde se desvían con un campo magnético. Cuando están inclinados entran en la hendidura de los cilindros, así, el electrómetro mide la carga transferida al cilindro. |
 |
![]() Segundo experimento
Segundo experimento
Todos los intentos de
inclinar los rayos catódicos en un campo eléctrico habían fallado. Thomson tubo otra
idea. Una partícula cargada normalmente se movería en curva a través de un campo
eléctrico, pero no si es rodeada por un conductor. Thomson sospechó que los restos de
gas en el tubo atravesaban los rayos catódicos como conductor. Para comprobar su idea,
extrajo todo el gas del tubo y encontró que los rayos catódicos se inclinaron en un
campo eléctrico después de todo.
De los dos experimentos, su conclusión fue: “Veo que no puedo
negar la conclusión de que los rayos catódicos son cargas eléctricas negativas
transportadas por partículas de materia.
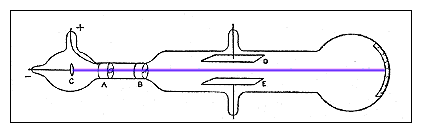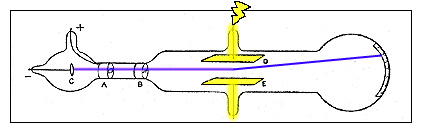 |
Gráfico esquemático del aparato de Thomson en el segundo experimento. Los rayos del cátodo (c) pasan a través de una hendidura en el ánodo (a) y a través de una hendidura en un enchufe de metal conectado a tierra(B). un voltaje eléctrico se establece entre las placas de aluminio (D y E), y una escala pegada en el exterior del extremo del tubo mide la desviación de los rayos.
![]() Tercer experimento
Tercer experimento
El tercer experimento de Thomson intentó determinar las propiedades básicas de las partículas. Aunque él no podría medir directamente la masa o la carga eléctrica de tal partícula, pudo medir cuánto fueron doblados los rayos por un campo magnético, y cuanta energía llevaban. De estos datos pudo calcular la relación de transformación de la masa de una partícula a su carga eléctrica (m/e). Él recogió datos usando una variedad de tubos y con diversos gases.
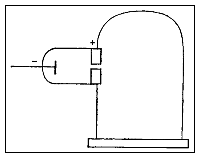 |
Gráfico esquemático de uno de los tubos usados en el tercer experimento de Thomson. Los rayos se originan en el cátodo a la izquierda y pasan a través de una hendidura en el ánodo a una campana de cristal que contiene el gas a baja presión. Los caminos desviados de los rayos se fotografían contra una placa de cristal gobernada. |
![]() Conclusion de Tompson
Conclusion de Tompson
"Tenemos materia en un nuevo
estado en los rayos catódicos, un estado que siendo subdivisión de la materia traerá
más futuro que el ordinario estado gaseoso: un estado que en toda la materia... es uno y
de la misma clase, esta materia que existe en todas las sustancias y de la cual estan
hechos todos los elementos químicos”.
Thomson encontró que la relación entre la carga eléctrica y la masa
de un electrón es de -1.76x108 C/g. Después entre 1908 y 1917, R. A. Millikan descubrió
que la carga del electrón es 1.60x10-19 C. Así la masa del electrón se calcula:
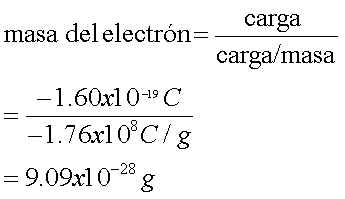 |