

El agua es una sustancia tan común en la Tierra que a menudo se menosprecia su naturaleza única. Todos los procesos vitales requieren agua. El agua es un disolvente excelente para muchos compuestos iónicos, así como para otras sustancias capaces de formar enlaces de hidrógeno con el agua. El agua tiene un calor específico alto; la razón de ello es que para elevar la temperatura del agua (esto es, aumentar la energía cinética promedio de las moléculas de agua), se deben romper primero muchos enlaces de hidrógeno intermoleculares. Por ello, el agua puede absorber una gran cantidad de calor mientras que su temperatura sólo aumenta ligeramente. Lo inverso también es cierto: el agua puede proporcionar mucho calor con una disminución muy ligera en su temperatura. Por esta razón, las cantidades inmensas de agua que están presentes en los lagos y océanos pueden moderar eficazmente el clima de las áreas adyacentes absorbiendo calor en verano y proporcionando calor en invierno, con sólo ligeros cambios en la temperatura del cuerpo del agua.
La propiedad más sobresaliente del agua es que su forma sólida es menos densa que su forma líquida: un cubo de hielo flota en la superficie del agua en un vaso. Ésta es virtualmente una propiedad única. La mayoría de las otras sustancias tienen una mayor densidad en el estado sólido que en el estado líquido.
Para comprender por qué el agua es diferente se tiene que examinar la estructura electrónica de la molécula de H2O. Hay dos pares de electrones no enlazados, o pares libres, en el átomo de oxígeno.
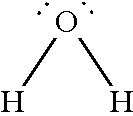 |
A pesar de que muchos compuestos son capaces de formar enlaces de hidrógeno intermoleculares, existe una diferencia significativa entre el H2O y otras moléculas polares, tales como NH3 y HF. En el agua, el número de enlaces de hidrógeno alrededor del átomo de oxígeno es igual a dos, el mismo número de pares libres en cada átomo de oxígeno. Así, las moléculas de agua se enlazan en una gran red tridimensional en la cual cada átomo de oxígeno está unido aproximadamente a cuatro átomos de hidrógeno, dos por enlaces covalentes y dos por enlaces de hidrógeno. Esta igualdad en el número de átomos de hidrógeno y de pares libres no es característica ni del NH3 ni del HF, ni de ninguna otra molécula capaz de formar enlaces de hidrógeno. En consecuencia, estas otras moléculas pueden formar anillos o cadenas, pero no estructuras tridimensionales.
La estructura tridimensional altamente ordenada del hielo (ver figura ![]() ), evita que las moléculas se acerquen mucho entre sí. Pero considérese lo que ocurre cuando el hielo recibe calor y se funde. Hay una gran evidencia que demuestra que la estructura tridirnensional permanece intacta por cierto tiempo, aun cuando los enlaces pueden llegar a doblarse y aun distorsionarse. En el punto de fusión, un número relativamente pequeño de moléculas de agua tienen suficiente energía cinética para liberarse de los enlaces de hidrógeno intermoleculares. Estas moléculas quedan atrapadas en las cavidades de la estructura tridimensional. Como resultado hay más moléculas por unidad de volumen en el agua líquida que en el hielo. Así, como la densidad es igual a
masa/volumen, la densidad del agua es mayor que la del hielo. Al calentar más agua, más moléculas de agua se liberan de los enlaces intermoleculares de hidrógeno, así que precisamente sobre
el punto de fusión del agua la densidad tiende a aumentar al incrementar la
temperatura.
), evita que las moléculas se acerquen mucho entre sí. Pero considérese lo que ocurre cuando el hielo recibe calor y se funde. Hay una gran evidencia que demuestra que la estructura tridirnensional permanece intacta por cierto tiempo, aun cuando los enlaces pueden llegar a doblarse y aun distorsionarse. En el punto de fusión, un número relativamente pequeño de moléculas de agua tienen suficiente energía cinética para liberarse de los enlaces de hidrógeno intermoleculares. Estas moléculas quedan atrapadas en las cavidades de la estructura tridimensional. Como resultado hay más moléculas por unidad de volumen en el agua líquida que en el hielo. Así, como la densidad es igual a
masa/volumen, la densidad del agua es mayor que la del hielo. Al calentar más agua, más moléculas de agua se liberan de los enlaces intermoleculares de hidrógeno, así que precisamente sobre
el punto de fusión del agua la densidad tiende a aumentar al incrementar la
temperatura.
Por supuesto que, al mismo tiempo, el agua se expande al ser calentada y, en
consecuencia, su densidad disminuye. Estos dos procesos (la captura de las
moléculas libres de agua en las cavidades y la espansión térmica) actúan en
direcciones opuestas. De 0ºC a 4ºC predomina la captura de moléculas de agua
libre en la red tidimensional y el agua se hace más dense progresivamente. Sin
embargo, más allá de 4ºC, predomina la expansión térmica y la densidad del
agua disminuye al aumentar la temperatura. (ver figura ![]() )
)