

Los enlaces covalentes son los enlaces químicos más fuertes, y son formados al compartir de un par de electrones. La energía de un solo enlace covalente típico es de 80 kilocalorias aproximadamente por mol (kcal/mol). Sin embargo, esta energía en enlace puede variar de ~50 kcal/mol a ~110 kcal/mol dependiendo de los elementos implicados. Una vez que estén formados, los enlaces covalentes se rompen raramente de manera espontánea. Esto es debido a las consideraciones enérgias simples; la energía termica de una molécula en la temperatura ambiente (298 K) es solamente ~0.6 kcal/mol, mucho más bajos que la energía requerida para romper un enlace covalente. Hay enlaces covalentes sencillos, dobles, y triples:
| Tipo de Enlace | Ejemplo | Energía (kcal/mol) |
| Sencillo |
H |
~80 |
| Doble |
H H | | H--C==C--H | | H H |
~150 |
| Triple |
H |
~200 |
Note que los enlaces carbono- carbono son enlaces covalentes extraordinariamente fuertes y estables.
Los elementos orgánicos principales tienen capacidades estándares de enlace:
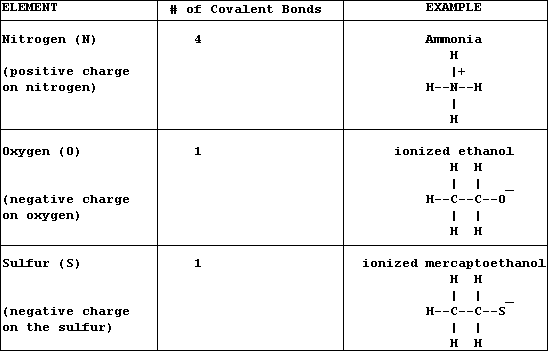 |
![]() La
polaridad de los átomos covalentes
La
polaridad de los átomos covalentes
Dos átomos con la misma electronegatividad compartirán los pares de electrones del enlace igualmente. Consecuentemente los electrones del enlace serán distribuidos uniformemente entre los átomos enlazados. No habrá acumulación de los electrones del enlace en ningún un átomo y el momento dipolo dle enlace será cero. Este tipo de enlace covalente será llamado "enlace no polar". El enlace entre dos Hidrogenos como en H2, dos Oxigenos como en el O2 o dos Nitrogenos como el N2 son todos enlaces no polares.
Por otra parte, si los dos átomos enlazados tienen un diferente electronegatividad entonces los pares de electrones enlazados serán compartidos desigualmente. El átomo con la electronegatividad más alta atraerá los electrones del enlace más cercano a sí mismo. Consecuentemente la distribución del electrón será desigual y se formará un enlace de momento dipolo. Por ejemplo el enlace sencillo entre un hidrógeno y un cloro como en H-Cl tendrá el par del enlace más cercano al átomo más electronegativo (el cloro). Consecuentemente el extremo del cloro será parcialmente negativo puesto que los electrones están más cercano al cloro. El extremo del hidrógeno será parcialmente positivo puesto que el par del enlace es más lejano del hidrógeno. Esta condición de dos polos se llama un dipolo y genera un momento dipolo que es un vector fuerza dirigido hacia el átomo más electronegativo en el enlace. Tal enlace se refiere como "enlace polar". Mientras mayor sea la diferencia de electronegatividad entre los dos átomos enlazados más polar será el enlace.
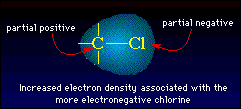 |
|
En la figura podemos ver como aumenta la densidad electrónica debido a que el cloro es más electronegativo |
El enlace covalente coordinado es similar al enlace covalente en que los pares del enlace están compartidos a veces igualmente y a veces desigualmente. Sin embargo el enlace covalente coordinado es diferente en que el par del enlace viene de solamente uno de los átomos, llamado átomo donador. El otro átomo, el átomo de receptor, simplemente acepta las responsabilidades del enlace. Un ejemplo de tal enlace es el siguiente:
:NH3 + H+ ------> NH3--->H+
El átomo del nitrógeno en el NH3 tiene un par solitario que se pueda donar como par compartido. Un ion de hidrógeno que no tiene ningún electrón a donar puede formar un enlace covalente coordinado con el átomo del nitrógeno. Una situación similar es cuando una molécula de agua dona un par solitario que se compartirá con un ion de hidrógeno:
Muchos metales de transición formarán tal enlace con los orbitales "d" aceptando pares de enlace de otros átomos o grupos de átomos llamados los "enlazantes". Estos átomos metalicos centrales forman compuestos coordinados complejos o inoes los cuales son basicamente mantenidos por el enlace covalente coordinado.